배터리 작동 원리
벽시계, TV 리모콘, 무선 조종 어린이 장난감은 어떻게 작동하나요? 대부분의 사람들은 주저하지 않고 "배터리에서"라고 대답할 것이며 원칙적으로는 옳을 것입니다. 그러나 그들 중 누구도 휴대용 배터리가 정확히 어떻게 3배로 증가했는지, 어떻게 작동하는지, 배터리에서 최종 소비자에게 전류를 전송하는 전체 프로세스가 불가능할 것이라고 말할 수는 없을 것입니다. 이 짜증나는 지식 격차를 메우자.
배터리 작동 원리
기존 AA 배터리의 작동 원리를 이해하려면 배터리 구조에 대한 전반적인 이해가 필요합니다. 따라서 모든 배터리는 양극, 음극 및 전해질의 세 가지 주요 요소로 구성됩니다. 더욱이 후자는 사실상 모든 응집 상태를 가질 수 있습니다. 식염수 용액에 놓인 음극과 양극은 원칙적으로 일반 사람에게는 특이한 형태의 "배터리"이기도 합니다.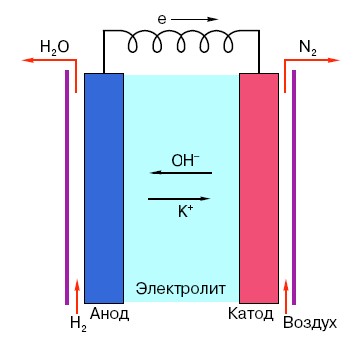
흥미로운! 알레산드로 볼타(Alessandro Volta)가 발명한 소위 "볼타 기둥"도 전류 생산에 필요한 모든 요소를 갖추고 있었습니다. 아연판과 구리판을 겹겹이 쌓아 만든 것인데, 그 사이에 산을 적신 천을 '층'으로 얹은 것입니다.
이러한 시스템의 양극은 학교 물리학 과정에서 알 수 있듯이 음전하를 띠는 전자의 주요 공급원입니다.음전하를 띤 입자는 양극 입자에 끌리며, 이 경우 음극 표면은 "플러스" 역할을 합니다.
그러나 이것은 전류가 발생하기에는 충분하지 않습니다. 왜냐하면 전자에는 음극과 양극의 상호 작용을 지원하는 매체인 일종의 "고속도로"가 필요하기 때문입니다. 전류를 전도할 수 있는 염, 알칼리 또는 산인 전해질이 "무대에" 나타나는 곳이 바로 여기입니다.
구체적인 예를 사용하여 작동 원리를 살펴보겠습니다. 정격이 18V인 배터리가 있습니다. 전극 사이의 전압은 네트워크에 연결될 때까지 안정적입니다. 소비자 (예 : 일반 전구)가 나타나 자마자 전압이 점차 감소하기 시작하고 전류가 "음극"에서 "양극"으로 흐르기 시작하며 전해질에서 화학 반응이 발생합니다. 전극 사이의 전위차를 유지합니다.
참조. 소비자가 더 많은 에너지를 필요로 할수록 배터리 내부의 반응은 더 강해지고 더 빨리 고장납니다.
충전식 배터리의 작동 방식, 일반 배터리와 다른 점
그래서 우리는 고전적인 "손가락" 및 "새끼손가락" 배터리를 살펴본 결과 대부분의 배터리 수명이 (유명 제조업체의 말과 상관없이) 엄격하게 제한되어 있다는 것을 알고 있습니다. 그러나 반응 과정에서 에너지를 소비할 뿐만 아니라 이를 축적하여 오랫동안 저장할 수 있는 소위 배터리, 즉 배터리형 배터리는 어떻습니까?
배터리의 작동 원리를 이해하려면 화학을 살펴볼 필요가 있습니다. 예를 들어 보겠습니다. 일반 숯불입니다.불꽃이 아무리 아름답고 매력적으로 보이더라도 그것을 관찰하는 화학자는 이 과정이 단지 연료 산화의 장기적인 반응일 뿐이라는 것을 알고 있습니다. 불타는 석탄은 산소와 상호 작용하며 이 반응의 결과로 다음과 같은 결과를 얻습니다.
- 이산화탄소;
- 빛;
- 따뜻한.
그리고 마지막 두 지점이 영혼과 몸을 따뜻하게 할 수 있다면 이산화탄소는 반응의 부산물이며 실제로는 폐기물이기 때문에 어떤 식으로도 이산화탄소를 사용할 수 없습니다. 시작 요소인 산소와 석탄이 고갈되면 산화 반응이 중지됩니다. 출발 물질이 완전히 소진되고 "폐기물"만 남을 때 배터리의 반응 중지는 정확히 동일한 방식으로 발생합니다.
배터리에서는 모든 것이 약간 다르게 발생합니다. 사실 그 안에서 일어나는 반응은 가역적 범주에 속합니다. 즉, 특정 조건에서는 "역전"되어 모든 물질을 원래 상태로 되돌릴 수 있습니다. 배터리에서 가역적 반응이 일어나 충전이 가능해질 가능성이 있습니다.
네트워크에 연결된 배터리에서는 반응이 반대 방향으로 진행되며 전류는 "플러스"에서 "마이너스"로 흐르고 그 반대는 아닙니다. 결과적으로 반응 생성물은 출발 물질을 형성하고 배터리 소유자는 휴대용 형식으로 사용 가능한 "회수" 에너지를 받습니다. 그게 다야!





